החוקרים הצליחו להפחית את הסיכון להתפתחות גרורות סרטניות בעקבות הטיפול מ-52% ל-6% בלבד בחיות מודל


מחקר
החוקרים הצליחו להפחית את הסיכון להתפתחות גרורות סרטניות בעקבות הטיפול מ-52% ל-6% בלבד בחיות מודל

פיתוח חדש של אוניברסיטת תל אביב עשוי לייעל מאוד את הטיפול הכימותרפי בקרב חולות סרטן השד, ולהפחית את הסיכון להתפתחות גרורות סרטניות בעקבות הטיפול מ-52% ל-6% בלבד. במסגרת המחקר, שנערך על חיות מודל, החוקרים זיהו את המנגנון שמייצר את הסביבה הדלקתית באזור בגוף שטופל על ידי כימותרפיה, ומצאו כי על ידי שילוב גורם מדכא-דלקת בכימותרפיה ניתן למנוע את הגרורות.
המחקר נערך בהובלת פרופ' נטע ארז מהמחלקה לפתולוגיה בבית הספר לרפואה וחברי צוות המעבדה: לאה מונטרן, ד"ר נור ארשייד, יעל זית, ויעלה שרף, וכן בשיתוף פרופ׳ איריס ברשק מהמרכז הרפואי שיבא, וד"ר אמיר זוננבליק מהמרכז הרפואי תל אביב (איכילוב). המאמר פורסם בכתב העת היוקרתי Nature Communications, ומומן על ידי הקהילה האירופית (ERC), האגודה למלחמה בסרטן וקרן אמרסון לחקר הסרטן.
"במקרים רבים של סרטן השד, הגידול מוסר בניתוח, ואחר כך ניתנת לחולה סדרה של טיפולי כימותרפיה, במטרה לחסל שרידי סרטן שהמנתח לא הצליח להסיר או שכבר התפזרו בגוף," מסבירה פרופ' ארז. "הכימותרפיה אמנם הורגת תאים סרטניים, אך לא פעם יש לה גם תופעות לוואי בלתי רצויות. אחת החמורות שבהן היא יצירת נזק ברקמות הבריאות, ודלקת אשר באופן פרדוקסלי עלולה לסייע לתאים סרטניים שנותרו לפתח גרורות באיברים אחרים בגוף. אנחנו ביקשנו לבחון איך זה קורה, ולנסות למצוא פתרון לתופעה הקטלנית."
במסגרת המחקר יצרו החוקרים מודל של חיות עם סרטן השד, שעברו מסלול דומה לזה של נשים חולות: הסרת הגידול הראשוני בניתוח, ואחר כך כימותרפיה ומעקב כדי לזהות בהקדם הישנות גרורתית של המחלה. החוקרים עקבו אחר מצבן של החיות, והממצאים היו מדאיגים: אצל חלק ניכר מהן התפתחו גרורות בריאות – בשיעור דומה להתפתחות גרורות בקבוצת הבקרה.
כעת ביקשו החוקרים לעקוב אחר תהליך התפתחות הגרורות. לשם כך הם בחנו את מצב הריאות של חיות המודל בשלב ביניים – כאשר ייתכן שכבר נוצרו בהן מיקרו-גרורות נסתרות, אך לא ניתן לזהותן אפילו באמצעי דימות מתקדמים כמו CT. "בבני אדם התקופה הזאת שבין הטיפול הכימותרפי לבין הופעת גרורות הניתנות לאיתור היא מעין 'קופסה שחורה'," אומרת פרופ' ארז. "בחיות המעבדה יכולנו לבדוק מה באמת קורה שם, ומצאנו מנגנון משמעותי שלא היה ידוע עד עתה: הטיפול הכימותרפי עורר תגובה דלקתית בפיברובלסטים, שהם תאי רקמת החיבור של הריאות, והתאים הללו זימנו למקום תאי חיסון ממח העצם. כך נוצרה באזור סביבה דלקתית שדווקא תומכת בהתפתחותן של המיקרו-גרורות, והן הפכו לגרורות סרטניות של ממש. בשורה התחתונה: הכימותרפיה, שנועדה להילחם בסרטן, השיגה דווקא תוצאה הפוכה."
החוקרים זיהו את המנגנון שבאמצעותו גייסו הפיברובלסטים את תאי מערכת החיסון ואז ״חינכו״ אותם לסייע לגידול. "גילינו שבתגובה לטיפול הכימותרפי הפיברובלסטים הפרישו חלבונים שנקראים 'חלבוני המשלים'. מדובר בחלבונים שמתווכים ומגבירים דלקות, בין השאר על ידי גיוס תאי דם לבנים של מערכת החיסון אל אזורים בהם יש זיהום או נזק רקמתי (תהליך שמכונה כימוטקסיס). כשתאי מערכת החיסון הגיעו לריאות הם יצרו סביבה דלקתית שתומכת בתאים הסרטניים ומסייעת להם להתפתח."
כאמצעי נגד, החליטו החוקרים לשלב עם הטיפול הכימותראפי גם תרופה שמעכבת את פעילות חלבוני המשלים, במטרה למנוע את ההשפעה הבלתי רצויה של הטיפול. התוצאות היו מעודדות ביותר: שיעור חיות המודל שכלל לא פיתחו גרורות לאחר הטיפול עלה מ-32% ל-67%; ושיעורן של אלה שפיתחו גרורות במוקדים רבים בריאותיהן ירד מ-52% בכימותרפיה רגילה, ל-6% בכימותרפיה בתוספת מעכב הדלקת.
"במחקר שלנו הצלחנו לגלות את המנגנון העומד מאחורי בעיה חמורה בטיפול בחולות סרטן השד: חלק ניכר מהן מפתחות גרורות גם לאחר שהגידול הראשוני הוסר וניתן להן טיפול כימותרפי. זיהינו מנגנון דלקתי שבאמצעותו הכימותרפיה דווקא מסייעת להתפתחות הגרורות, ואף מצאנו פתרון: הוספת גורם מעכב דלקת לטיפול הכימותרפי. אנחנו מקווים שבעתיד הממצאים שלנו יגיעו לקליניקה ויאפשרו לרופאים להעניק טיפול יעיל יותר לסרטן השד, ואולי אף לסוגי סרטן אחרים – טיפול שימנע את הישנות המחלה ויציל את חייהם של חולים רבים בכל העולם," מסכמת פרופ' ארז.

מחקר
שילוב של אולטראסאונד וננובועות מאפשר השמדת גידולים סרטניים ללא צורך בטיפול פולשני

השיטה המקובלת כיום לטיפול בסרטן היא הסרה כירורגית של הגידול, בשילוב עם טיפולים משלימים (כימותרפיה, אימונותרפיה וכו'). אולטראסאונד טיפולי מהווה חלופה לא פולשנית להרס הגידול הסרטני במקום ניתוח.
לשיטה זו יש יתרונות וחסרונות. מצד אחד, היא מאפשרת טיפול מקומי וממוקד - שימוש באולטראסאונד בעוצמה גבוהה יכול לייצר אפקטים תרמיים או מכניים בעזרת אספקתה של אנרגיה אקוסטית רבת עוצמה לנקודת מוקד עם דיוק מרחבי-זמני גבוה. שיטה זו יושמה ביעילות לטיפול בגידולים מוצקים בעומק הגוף. בנוסף, הוא מאפשר לטפל בחולים שאינם כשירים לכריתת גידול כירורגית. מנגד, החיסרון הוא בכך שהחימום והעוצמות הגבוהות של גלי האולטראסאונד עלולים לפגוע ברקמות הנמצאות ליד הגידול עצמו.
טכנולוגיה חדשה של אוניברסיטת תל אביב מאפשרת להשמיד גידולים סרטניים בצורה ממוקדת ובאמצעות שילוב של אולטראסאונד והחדרת ננובועות למחזור הדם. לטענת צוות החוקרים, בניגוד לשיטות טיפול אחרות שכללו חדירה פולשנית לגוף והזרקה של מיקרובועות לתוך הגידול עצמו, הטכנולוגיה החדישה מאפשרת את השמדת הגידול ללא צורך בטיפול פולשני.
המחקר נערך בהובלת הדוקטורנט מייק ביסמוט מצוות המעבדה של ד"ר טלי אילוביץ במחלקה להנדסה ביו־רפואית, ובשיתוף ד"ר דב הרשקוביץ מהמחלקה לפתולוגיה בפקולטה לרפואה ע"ש סאקלר. כמו כן, השתתפה במחקר גם פרופ' אגתה אקסנר מאוניברסיטת קייס ווסטרן ריזרב שבקליבלנד ארה"ב. המחקר פורסם בכתב העת "Nanoscale".
במחקר החדש, ד"ר אילוביץ וצוותה ניסו להתגבר על הבעיה של הפגיעה ברקמות הבריאות. במסגרת הניסוי, שכלל מודל חיות, החוקרים הצליחו להשמיד את הגידול על ידי הזרקה של ננובועות למחזור הדם (בניגוד להזרקה מקומית לגידול עצמו של מיקרובועות עד היום), בשילוב גלי אולטראסאונד בתדירות נמוכה ועם מינימום השפעות מחוץ למטרה.
"הטכנולוגיה החדשה שלנו מאפשרת להזריק למחזור הדם, בצורה יחסית פשוטה, ננובועות שמתרכזות באזור הגידול הסרטני," אומרת ד"ר טלי אילוביץ. "לאחר מכן, באמצעות הפעלה של אולטרסאונד בתדר נמוך אנחנו מפוצצים את הננובועות וע"י כך את הגידול שאותו הן מקיפות. השילוב של ננובועות ביחד עם גלי אולטראסאונד בתדירות נמוכה מספק ספציפיות רבה יותר לאיזור הגידול ותורמת להפחתת רעילות מחוץ למטרה. הפעלת התדר הנמוך על הננובועות, גורמת להן להתנפח ולהתפוצץ בצורה קיצונית כבר בלחצים נמוכים, דבר שמאפשר לבצע טיפול הרס מכני של הגידולים בספי לחץ קטנים. השיטה ניחנה ביתרונות של האולטראסאונד, בכך שהיא בטוחה, חסכונית וזמינה מבחינה קלינית, ובנוסף השימוש בננובועות מקל על המיקוד בגידולים, מכיוון שניתן לצפות בהם בעזרת הדמיית האולטרסאונד."
ד"ר אילוביץ מוסיפה כי השימוש באולטרסאונד בתדר נמוך מגביר בנוסף את עומק החדירה, ממזער עיוות והנחתה ומגדיל את נקודת המוקד. זה יכול לעזור בטיפול בגידולים הממוקמים עמוק ולהקל על הטיפול בנפחי גידול גדולים יותר בו זמנית. הניסוי נערך אומנם במודל של גידול סרטן שד בעכברים, אבל סביר להניח שהוא תואם לסוגי גידול אחרים ובעתיד יתכן ויותאם גם לבני אדם".

מחקר
פעילות אירובית עשויה להפחית ב-72% את הסיכון לסרטן גרורתי

מחקר חדש של אוניברסיטת תל אביב קובע כי פעילות אירובית עשויה להפחית ב-72% את הסיכון להתפתחות סרטן גרורתי. לטענת החוקרים באמצעות הפעילות האירובית המשמעותית ישנה עלייה בצריכת הגלוקוז (הסוכר) של האיברים הפנימיים, כך שלסרטן אין מקור אנרגיה זמין.
המחקר נערך בהובלת שני חוקרים מהפקולטה לרפואה ע"ש סאקלר באוניברסיטת תל אביב: פרופ' כרמית לוי מהמחלקה לגנטיקה של האדם וביוכימיה וד"ר יפתח גפנר מבית הספר לבריאות הציבור ומכון סילבן אדמס לספורט. המחקר פורסם בכתב העת היוקרתי Cancer Research.
פרופ' לוי וד"ר גפנר: "המדע יודע להגיד שפעילות גופנית מונעת חלק מסוגי הסרטן בשיעור של עד 35%, בדומה לאפקט שלו על מחלות אחרות, כמו מחלות לב וסוכרת. החידוש שלנו במחקר הנוכחי הוא שאנחנו מראים כי פעילות גופנית שהמקור האנרגטי שלה הוא בסוכר, כלומר פעילות אירובית בעצימות גבוהה, מצליחה להפחית ב-72% את הסיכון לסרטן גרורתי. אם עד כה אמרנו לאנשים תהיו פעילים ותהיו בריאים יותר, היום אנחנו יודעים להגיד איזו פעילות, ובאיזו עצימות, תמקסם את הסיכוי למנוע את סוגי הסרטן האלימים והמטסטטיים ביותר".
החוקרים מאוניברסיטת תל אביב השתמשו הן בחיות מודל שהוכנסו למשטר אימונים והן במתנדבים בריאים שנבדקו לפני ואחרי אימון ריצה. במחקר אפדמיולוגי אשר נערך בקרב קרוב ל-3000 בני האדם, אשר עקב אחריהם במשך כ-20 שנה, החוקרים מצאו כי אצל אנשים אשר דיווחו על פעילות גופנית אירובית, התפתח ב-72% פחות סרטן גרורתי, לעומת אנשים אשר דיווחו על חוסר פעילות גופנית. להערכת החוקרים, הסיבה לכך שהן בחיות המודל והן בקרב בני האדם, לא התפתחו גרורות במרבית המקרים - קשורה לקצב צריכת הגלוקוז בגוף.
בחיות מודל, ניתן היה לפצח את המנגנון לתופעה שנצפתה בבני אדם. אחרי שנכנסו לכושר, החוקרים דגמו את האיברים הפנימיים של החיות לפני ואחרי פעילות גופנית וכן לאחר שחלו בסרטן. ממצאי המחקר עולה כי בקרב חיות המודל נמצא שפעילות גופנית אירובית הורידה באופן משמעותי את התפתחות הגרורות בבלוטות הלימפה, הריאות והכבד. פרופ' לוי מדגישה כי המחקר החדש, המשלב כוחות מדעיים מבתי ספר שונים בתוך האוניברסיטה, הביא לגילוי מחקרי חשוב ביותר במניעת מחלת הסרטן הגרורתי, שהיא סיבת המוות המובילה בישראל.
פרופ' לוי : "המחקר שלנו לראשונה נכנס פנימה, לתוך הגוף, ומפענח מה השפעת הספורט על רקמות הפנימיות, אשר בדרך כלל מארחות את הגרורות של הסרטנים הקשים ביותר כמו ריאות, כבד ולימפה. מצאנו כי בזמן פעילות אירובית בעצימות גבוהה, האיברים הפנימיים מעלים את כמות קולטני הסוכר בתאים ומעלים את צריכת הגלוקוז שלהם ובעצם הופכים למכונה משומנת לבליעת סוכר ואנרגיה, בדומה מאוד לשריר. אנו משערים כי מאחר ובזמן פעילות גופנית השרירים שורפים המון גלוקוז, האיברים הפנימיים מגיבים לאתגר ומעלים את יכולת בליעת הסוכר שלהם, כדי לעמוד בקצב ובתחרות על משאב הסוכר. כשמופיע הסרטן, הוא לא מצליח לשלוח גרורות כי הוא נמצא בתחרות עזה על הגלוקוז ברקמה המיומנת (זו שעשתה התעמלות). מדובר במצב כרוני אצל מי שמתעמל קבוע: רקמות האיברים הפנימיים משתנות, והופכות להיות דומות יותר לרקמת שריר, וזה מצע רע מאוד לסרטן – שגם הוא זקוק לגלוקוז. כולנו יודעים שבריא לעשות ספורט. החידוש שלנו הוא הכניסה פנימה לתוך האיברים והגילוי שבעצם כל הגוף משתנה, ובכך הסרטן גם לא מצליח להתפשט ולשלוח גרורות וגם הגידול המקורי קטן".
ד"ר גפנר מדגיש כי בניגוד לפעילות גופנית למטרת שריפת שומן או בריאות כללית, תוצאות המחקר מראות שיש להתאמן בעצימות גבוהה כדי למנוע את התפתחות הסרטן ואת התפשטותו בגוף.
ד"ר גפנר: "אם 70-65% מהדופק המקסימלי הוא הטווח הנכון להפקת אנרגיה משומן, כדי 'לשרוף' סוכר יש לעבור ל-85-80% מהדופק המקסימלי – אפילו לפרקי זמן קצרים, למשל ריצה מהירה של דקה ואז הליכה, ושוב ריצה קצרה ומהירה. אם בעבר אינטרוולים כאלה היו חלק משגרת האימונים הייחודית של ספורטאים, כבר היום אנחנו רואים שילוב של אימונים אינטרוולים בשיקום לב וריאות למשל. תוצאות המחקר שלנו מעידות כי גם לאנשים בריאים חשוב לשלב התעמלות בעצימות גבוהה בשגרת האימונים שלהם. אני מאמין שמחקרים נוספים בעתיד יאפשרו להציע רפואה מותאמת אישית למניעת מחלות סרטן ספציפיות. אנחנו נלך לרופא עם היסטוריה משפחתית של תחלואת סרטן מסוימת, ולפיה ימליצו לנו על סוג הפעילות. חשוב להדגיש שלפעילות הגופנית יש השפעות מטבולית ופיזיולוגיות ייחודיות, עם תוצאות במניעת סרטן שאף תרופה או התערבות רפואית אחרת לא מסוגלת להגיע אליהן".

מחקר
באמצעות מודלים תלת ממדיים של סרטן מסוג מלנומה הצליחו החוקרים לפענח את הגעת הגרורות למוח

"בשלב מתקדם של סרטן העור מסוג מלנומה, ל-90% מהחולים יופיעו גרורות במוח", מסבירה פרופ' רונית סצ'י-פאינרו מהפקולטה לרפואה ע"ש סאקלר באוניברסיטת תל אביב. "זה נתון מעורר תהייה. אנחנו מצפים לראות גרורות בריאות ובכבד, אבל המוח אמור להיות איבר שמור. מחסום הדם-מוח שומר שחומרים מזיקים לא ייכנסו פנימה, ופה הוא כביכול לא עושה את העבודה – תאי סרטן מהעור מסתובבים בדם ומצליחים להגיע למוח. אנחנו שאלנו את עצמנו עם מי במוח 'מדברים' תאי הסרטן כדי להסתנן פנימה".
במחקר שנערך בהובלת פרופ' סצ'י-פאינרו והדוקטורנטית סבינה פוצי, הצליח צוות המחקר לראשונה לפענח את המנגנון שמאפשר לסרטן העור לשלוח גרורות למוח, והצליחו באמצעות טיפולים קיימים לעכב ב-60% עד 80% את התפשטות הגרורות במוח. המחקר פורסם בכתב העת JCI Insight.
מנתוני מעבדה שנאספו על חולים, מצאו החוקרים מאוניברסיטת תל אביב שתאי הסרטן "מגייסים" תאים בשם אסטרוציטים, תאים בצורת כוכב הנמצאים בחוט השדרה ובמוח ואחראים על ההומאוסטזיס במוח. "האסטרוציטים הם הראשונים שבאים לתקן את המצב במקרה של שבץ או טראומה למשל, ודווקא איתם מדברים תאי הסרטן, מחליפים מולקולות ומשחיתים אותם," מסבירה פרופ' סצ'י-פאינרו. "לא זאת בלבד שתאי הסרטן מגייסים את האסטרוציטים כך שלא יבלמו את התפשטות הגרורות, הם יוצרים דלקות מקומיות באזורי התקשורת שמגבירים את החדירות דרך מחסום הדם-מח, וכן את חלוקת ואת נדידת התאים הסרטניים".
פרופ' סצ'י-פאינרו מוסיפה כי "התקשורת ביניהם באה לידי ביטוי בכך שהאסטרוציטים מתחילים להפריש חלבון המעודד דלקת בשם MCP-1 (הידוע גם בכינוי CCL2), ובתגובה לכך, התאים הסרטניים מתחילים לבטא את הרצפטורים (הקולטנים) שלו CCR2 ו-CCR4. אנחנו חשדנו שקולטנים אלו, הם אלה שאחראים גם לתקשורת המשחיתה עם האסטרוציטים".
כדי לבדוק את ההשערה שלהם, פרופ' סצ'י-פאינרו וצוותה ניסו לעכב את ביטוי החלבון והרצפטורים בחיות מודל מהונדסות גנטית ובמודלים תלת-ממדיים של מלנומה ראשונית ושל גרורות מוחיות. לשם כך, החוקרים השתמשו בשיטת טיפול מוכרת, הכוללת טיפול בנוגדן (מולקולה ביולוגית) ובמולקולה קטנה (סינתטית), ואשר מיועדת בין היתר לטיפול בבעיות בכבד, בבעיות בכליות הקשורות בסוכרת (נפרופטיה) ומחלות לב. הטיפול בנוגדן (מולקולה ביולוגית) ובמולקולה קטנה (סינתטית) נועדו לחסום את החלבון MCP-1.
כמו כן, החוקרים נעזרו בטכנולוגיית קריספר – אשר שימשה לעריכה גנטית לחיתוך שני הגנים המבטאים את שני הקולטנים הרלוונטים, CCR2 ו-CCR4. בכל אחת מהשיטות הצליחו החוקרים לעכב את התפשטות הגרורות.
פרופ' סצ'י-פאינרו: "הטיפולים הללו הצליחו הן לעכב את חדירת תאי הסרטן למוח והן את התפשטות הסרטן במוח, אנחנו הגענו ל-60% עד 80% עיכוב, תלוי בשלב ההתערבות. בנוסף, התוצאות הטובות ביותר התקבלו בטיפול שנערך מיד אחרי הניתוח להסרת הגידול המקורי, כאשר הצלחנו למנוע מראש את חדירת הגרורות למוח, לכן אני מאמינה שהטיפול מתאים לקליניקה כצעד מנע להתפתחות גרורות. יש להבין שגרורות מלנומה במח הינן מאוד אגרסיביות. גם הנוגדן וגם המולקולה הקטנה שנועדו לטפל בעיקר בסקלרוזיס, סוכרת, פיברוזיס בכבד ומחלות לב וכביומרקר בסוגי סרטן אחרים, כבר נוסו על בני אדם במסגרת ניסויים קליניים, כך שאנו יודעים שטיפולים אלה בטוחים, ואפשר לנסות לעשות להם התוויה חדשה למלנומה".
למחקר היו שותפים מאוניברסיטת תל אביב גם פרופ' עדי ברזל, ד"ר אסף מדי, פרופ' איריס ברשק, פרופ' ערן פרלסון, ופרופ' אינה סלוצקי, וכן שותפים מה-NIH: פרופ' איתן רופין מג'ונ'ס הופקינס, פרופ' הנרי ברם ותומאס הייד, ומאוניברסיטת ליסבון - פרופ' הלנה פלורינדו.
המחקר החדש מומן על ידי מועצת המחקר האירופית (ERC Advanced), הברית לחקר המלנומה Melanoma Research Alliance (MRA), קרן קאהן, הקרן לחקר הסרטן בישראל (ICRF) והקרן הלאומית למדע (ISF).

מחקר
ייתכן שבאמצעות הטיפול בנוגדנים לא נצטרך לספק מנות בוסטר לכלל האוכלוסייה בכל פעם שיש וריאנט חדש

פריצת דרך מדעית של אוניברסיטת תל אביב: צוות חוקרים מאוניברסיטת תל אביב הראה שנוגדנים שבודדו ממערכת החיסון של מחלימי קורונה יעילים ב-95% בנטרול כל הזנים הידועים של הנגיף, כולל הדלתא והאומיקרון. לטענת החוקרים, התגלית עשויה להחליף את הצורך במתן חיסונים ולחזק את המערכת החיסונית של אוכלוסיות בסיכון.
המחקר נערך בהובלת ד"ר נטליה פרוינד והדוקטורנטים מיכאל מור ורופן לי מהמחלקה למיקרוביולוגיה מולקולרית וביוטכנולוגיה בפקולטה לרפואה ע"ש סאקלר. המחקר נערך בשיתוף ד"ר בן קרוקר מאוניברסיטת קליפורניה בסן דייגו ופרופ' יא ז'יאנג מאוניברסיטת טצ'ינהואה בביג'ינג. כמו כן השתתפו במחקר פרופ' מיטל גל-תנעמי וד"ר משה דסאו מאוניברסיטת בר אילן.
מחקר זה, הוא למעשה המשכו של מחקר מקדים שנערך באוקטובר 2020, בעיצומו של משבר הקורונה. ד"ר פרוינד ועמיתיה ריצפו אז את כל תאי מערכת החיסון מסוג בי מדמם של מחלימי הזן "המקורי" של הקורונה בישראל – ובודדו תשעה נוגדנים שהחולים ייצרו. כעת, מסתבר שחלק מהנוגדנים הללו יעילים מאוד בנטרול זני הקורונה החדשים, דלתא ואומיקרון.
ד"ר פרוינד: "במחקר הקודם הראינו שהנוגדנים השונים שנוצרים בתגובה להדבקה בנגיף הקורונה "המקורי" מכוונים כנגד אתרים שונים של הנגיף. הנוגדנים הכי יעילים היו אלה שנקשרו לחלבון ה'ספייק' של הנגיף, באותו המקום שבו הספייק קושר את הרצפטור התאי בשם ACE2. כמובן, שלא היינו היחידים שבודדו נוגדנים אלה, ומערכת הבריאות העולמית עשתה בהם שימוש נרחב עד להגעתם של הווריאנטים השונים של הנגיף הקורונה, שלמעשה הפכו את רוב אותם נוגדנים לחסרי תועלת".
במחקר הנוכחי הוכחנו ששני נוגדנים אחרים, TAU-1109 ו-TAU-2310, שקושרים את הנגיף באזור אחר מהאזור שבו התמקדו רוב הנוגדנים עד כה (ולכן גם היו פחות יעילים בנטרול הזן המקורי) דווקא יעילים מאוד בנטרול הדלתא והאומיקרון. על פי הממצאים שלנו יעילות הנוגדן הראשון TAU-1109 בנטרול זן האומיקרון עומדת על 92% ובנטרול הדלתא – על 90%. הנוגדן השני, TAU-2310 מנטרל את האומיקרון ביעילות של 84% ואת הדלתא ביעילות של 97%".
לדברי ד"ר פרוינד, היעילות המפתיעה של הנוגדנים הללו קשורה לאבולוציה של הנגיף: "יכולת ההדבקה של הנגיף עלתה מווריאנט לווריאנט, כי בכל פעם הוא שינה את רצף חומצות האמינו של האזור בספייק שנקשר לרצפטור ACE2 – וכך שיפר את יכולת ההדבקה, ובמקביל חמק מהנוגדנים הטבעיים שנוצרו בעקבות מתן חיסונים. לעומת זאת, נוגדני מערכת החיסון TAU-1109 ו-TAU-2310 מלכתחילה לא נקשרו לרצפטור ACE2 אלא לאזור אחר בספייק, אזור בנגיף שכנראה לא עובר מוטציות רבות – ולכן הם יעילים בנטרול כל הווריאנטים שבדקנו, ולמעשה בנטרול כל זני הקורונה הידועים עד היום".
שני הנוגדנים, המשובטים במעבדה של ד"ר פרוינד באוניברסיטת תל אביב, נשלחו לבדיקות יעילות מול נגיפים חיים במעבדות אוניברסיטת קליפורניה בסן דייגו ומול פסאודו-נגיפים במעבדות הפקולטה לרפואה בגליל של אוניברסיטת בר אילן – והתוצאות היו זהות ומעודדות בשתי הבדיקות.
ד"ר פרוינד מאמינה שהנוגדנים יכולים לחולל מהפכה של ממש במלחמה בקורונה: "צריך לשים את מגפת הקורונה בקונטקסט של ההתפרצויות האחרונות שידעה האנושות. אנשים שהתחסנו בלידה נגד אבעבועות שחורות והיום הם בני 50 – עדיין יש להם נוגדנים, ולכן הם כנראה מוגנים, לפחות חלקית, מנגיף אבעבועות הקוף שעליו אנחנו שומעים לאחרונה. לצערנו, זה לא המצב עם הקורונה. מסיבות שאנחנו לא לגמרי מבינים, רמת הנוגדנים נגד קורונה דועכת משמעותית אחרי שלושה חודשים, ולכן אנחנו רואים אנשים שנדבקים שוב ושוב, גם אחרי שהתחסנו שלוש פעמים.
לדעתנו, טיפול נקודתי בנוגדנים ואספקתם לגוף בריכוז גבוה יכול לשמש תחליף יעיל לחיסונים, במיוחד לאוכלוסיות בסיכון ולאנשים עם מערכת חיסונית מוחלשת. הידבקות בקורונה יכולה לגרום למחלה קשה, ואנחנו יודעים שמתן נוגדנים בימים הראשונים אחרי ההדבקה יכולה לעצור את התפשטות הנגיף. ייתכן שבאמצעות הטיפול בנוגדנים לא נצטרך לספק מנות בוסטר לכלל האוכלוסייה בכל פעם שיש וריאנט חדש".

מחקר
המעבדה של פרופ' יובל אבנשטיין הוכרזה כאחת המתקדמות באירופה במחקר ובפיתוח של פתרונות טכנולוגיים למחלת הסרטן

כשאביו של פרופ' יובל אבנשטיין מבית הספר לכימיה אובחן כחולה מיאלומה (סוג של סרטן הדם), יובל בדק וראה שרוב שיטות האבחון והמעקב הקיימות מבוססות על ביופסיות מח העצם והדמיות רדיולוגיות, שהן פרוצדורות יקרות, לא נעימות ובעלות סיכון למטופלים. הוא התחיל לדבר עם רופאים המטולוגים ולקרוא ספרות מקצועית בתחום, וראה, לשמחתו, שהמחקר שהוא מבצע במעבדה שלו יכול לקדם את התחום הזה באופן משמעותי.
ההיכרות שלו עם פרופ' עירית אביבי מאיכילוב, הדגישה אפילו יותר עד כמה גדול הפער בין המצוי ורצוי בתחום הזה. "פרופ' אביבי חיברה אותי עם ד״ר מירי נאמן, המטולוגית מומחית, שהצטרפה למעבדת המחקר שלי כדי לפתח את הכיוון הקליני של הפרויקט," מספר יובל.
במעבדה שלו מפתחים כבר במשך עשור מגוון שיטות המאפשרות לחבר מולקולות פולטות אור לשינויים כימיים בדנ"א. השינויים האלה הוכחו כבעלי יכולת ניבוי מעולה למחלות שונות, ובמיוחד לסוגי סרטן שונים, בשלבים מוקדמים של המחלה. על בסיס הטכנולוגיה הזו הקים אבנשטיין את חברת JaxBio, שהחלה לפעול בארץ בתחילת 2022, בהשקעה של מיליוני דולרים.
המעבדה מתמחה בתחומים רבים של הדמיה אופטית וספקטרוסקופיה עם דגש על איתור מולקולה בודדת ופיתוח טכניקות מבוססות הדמיה. "אנחנו מפתחים מתודולוגיות חדשות של ספקטרוסקופיה ומיקרוסקופיה המשלבות אופטיקה מתקדמת עם כלים וריאגנטים מתחום הננו-טכנולוגיה. בנוסף, יש לנו עניין רב בפיתוח ביוכימיה ייחודית לניתוח גנומי המבוססות על תגובות כימו-אנזימות," מסביר יובל.
המחקר במעבדה מתמקד בשלושה תחומים. הראשון, גנומיקת מולקולה בודדת על ידי מיפוי אופטי. מדובר ביצירת ברקודים אופטיים המכילים מידע גנטי ואפיגנטי על ידי תיוג מולקולות DNA כרומוזומליות ארוכות עם סמנים פלואורסצנטיים. תעלות ננו-נוזליות משמשות למתיחת ה-DNA על ידי זרימה או שדה חשמלי, והברקוד מוצג ישירות על ידי הדמיה של מולקולה אחת. "אנו שואפים ליישם טכניקות של רזולוציית-על (super-resolution), על מנת לאפשר זיהוי של סטיות גנומיות," אומר יובל.
התחום השני הוא טכנולוגיות ניתוח אפיגנטי. אפיגנטיקה היא אחד התחומים המרגשים והצומחים במהירות בביולוגיה. הוא קושר חתימות ביולוגיות עם תנאים נפשיים או סביבתיים. במעבדה מפתחים שיטות חדשות לריצוף, ניתוח ממוקד וגלובלי של סמנים אפיגנטיים שונים. בשיטות החדשות הללו הם משתמשים על מנת לחקור שינויים אפיגנטיים הקשורים למחלה.
התחום השלישי הוא זיהוי מולקולה בודדת בתפוקה גבוהה, כלומר פיתוח שיטות אופטיות וננו-ביו-חיישנים לזיהוי אנליטים נדירים וביומולקולות בעלות אינטראקציה חלשה. הדגש של החוקרים הוא על איתור רגיש וכימות של סמנים ביולוגיים קליניים. כדי להשיג את המטרה, הם מפתחים מערך אופטי המבוסס על מיקרו-עדשות שיכול לזהות פלואורסצנטיות של מולקולה בודדת. כמו כן, הם מפתחים סכימות לספירת מולקולות בודדות ופיתוח טכניקות הדמייה ברזולוציה גבוהה, וחומרי ניגוד מיוחדים המנצלים פלואורסצנטיות והעברת אנרגיה לצורך הדמיה ברזולוציית-על (SR).
פרופ' יובל אבנשטיין: לרתום את האפיגנטיקה לגילוי מוקדם של סרטן
פרופ' יובל אבנשטיין הוא אחד משלושה חוקרים שזכו לאחרונה במענק מטעם "משימת הסרטן" של התוכנית האירופית החדשה ("הורייזן יורופ"), שמטרתה מחקר ופיתוח בתחום ההתמודדות עם מחלת הסרטן. "הורייזן יורופ" היא התוכנית החדשה והגדולה אי פעם של האיחוד האירופי למימון מחקר וחדשנות.
"אנחנו מנסים לאפשר לגלות מגוון של סוגי סרטן בבדיקת דם נגישה. בדיקות הדם שלנו יוכלו לסייע בבחירת טיפול או מעקב המותאמים באופן מלא לחולה".
ב"משימת הסרטן", מדינת ישראל זכתה במקום הראשון מבין כל מדינות אירופה, עם תקציב של 15 מיליון אירו, שחולק בין החוקרים הזוכים, מה שמעמיד אותה כמדינה המתקדמת באירופה במחקר ובפיתוח של פתרונות טכנולוגיים למחלת הסרטן.
"היום כבר ברור שגילוי מוקדם של מחלות מציל חיים. סרטנים רבים ניתנים היום לטיפול אם מגלים אותם בזמן," אומר יובל, "הבעיה העיקרית היא שהסרטן מתגלה בדרך כלל לאחר הופעת תסמינים, מפני שאין שיטות סקר יעילות מספיק."
"אנחנו מנסים לאפשר לגלות מגוון של סוגי סרטן בבדיקת דם נגישה, שתוכל להתבצע פעם בשנה או שנתיים ותאפשר גילוי מוקדם. בנוסף, הרפואה כולה הופכת להיות מותאמת אישית. בדיקות הדם שלנו יוכלו לסייע בבחירת טיפול או מעקב המותאמים באופן מלא לחולה".
"בפיתוח שלנו יש פתרון טכנולוגי ייחודי שאינו מחייב ריצוף של הדנ"א, כפי שנדרש כרגע בפיתוחים קיימים אחרים, ולכן זה מוזיל את עלות הבדיקה פי 50. זה הופך את הבדיקה שלנו ממוצר לבעלי יכולת בלבד למוצר שהוא בהישג ידו של כל אדם, ואנו מקווים שישתלב כבדיקת מעקב שגרתית. יש לנו תוצאות ראשוניות מדהימות, ונראה שזה שכנע את מיטב המדענים באירופה לתת אמון בטכנולוגיה שלנו", אומר אבנשטיין.
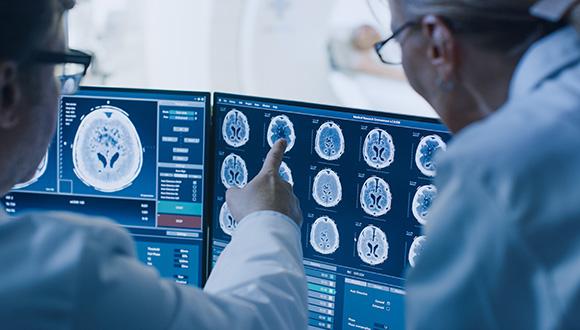
מחקר
חוקרים הצליחו לנטרל את מקור האנרגיה של הגידול ובכך גרמו להיעלמותו

סרטן הגליובלסטומה נחשב לאחד ממיני הסרטן הפולשניים והאלימים שיש. נכון להיום, מרבית החולים הסובלים ממנו מתים מהמחלה תוך חודשים ספורים מרגע גילויה. מחקר פורץ דרך של אוניברסיטת תל אביב הצליח לראשונה להביא לגוויעתו ולהיעלמותו של הסרטן הקטלני. במסגרת המחקר, שנערך על מודל החיות, חשפו החוקרים שני מנגנונים בסביבתו התומכת של הגידול, שהם קריטיים לשגשוגו של הסרטן האלים: האחד מגן עליו מפני מערכת החיסון, והשני מספק לו את האנרגיה הדרושה לו כדי לגדול. על פי הממצאים, בהיעדרם של מנגנונים אלו הגידול גווע ונעלם. ממצאי המחקר המרעישים עשויים לשמש בסיס מבטיח לפיתוח תרופות יעילות עבור הסרטן האלים וחשוך המרפא, וכן עבור גידולי מוח מסוגים אחרים.
"בחרנו לתקוף את האתגר של סרטן זה מזווית חדשה, ובמקום להתמקד בגידול עצמו, התמקדנו בסביבתו התומכת"
המחקר נערך בהובלת הדוקטורנטית ריטה פרלרוייזן, בהנחייתו ד"ר ליאור מאיו מבית הספר סגול למדעי המוח ומבית הספר שמוניס למחקר ביו-רפואי וחקר הסרטן בפקולטה למדעי החיים ע"ש ג'ורג' ס' וייז, ובשיתוף עם פרופ' איתן רופין מהמכונים הלאומיים לבריאות בארה"ב. המחקר פורסם בכתב העת היוקרתי Brain.
"נכון להיום, לרפואה אין מענה אפקטיבי ארוך טווח לטיפול בסרטן הגליובלסטומה. הוא עמיד במידה רבה לכל הטיפולים המוכרים, ותוחלת החיים של החולים קצרה מאוד ולא השתנתה משמעותית ב-50 שנה האחרונות. במחקר שלנו בחרנו לתקוף את האתגר של סרטן זה מזווית חדשה, ובמקום להתמקד בגידול עצמו, התמקדנו בסביבתו התומכת", מסביר ד"ר מאיו. "באופן ספציפי, עסקנו בתאים הקרויים אסטרוציטים - תאי מוח שקיבלו את שמם מצורתם דמוית הכוכב, ומוכרים למדע מזה כ-200 שנה. תאים אלה הינם הסוג העיקרי של תאי 'גלייה', שמוכרים בעיקר כתומכים בפעילות תקינה של המוח. יחד עם זאת, מחקרים מהעשור האחרון העלו שיש להם גם תפקידים נוספים, בין היתר בהקשר של מגוון מחלות של המוח, כאשר לפעמים הם תומכים בשיקום המוח ולעתים משתתפים דווקא ביצירת הנזק. כשבחנו גידולי גליובלסטומה מתחת למיקרוסקופ, ראינו שהם מוקפים באסטרוציטים פעילים ושאלנו: איזה תפקיד ממלאים האסטרוציטים בהתפתחות של גליובלסטומה?"

תאי אסטרוציטים דמויי כוכב, במבט תחת מיקרוסקופ
כדי לבחון את תפקיד האסטרוציטים בגליובלסטומה, נעזרו החוקרים במודל חיות מיוחד, שמאפשר 'להעלים' את תאי האסטרוציטים הפעילים מסביבת הגידול. בנוכחות האסטרוציטים, הגידול היה קטלני ב-100%, וכל החיות שחלו מתו בתוך 5-4 שבועות מרגע הופעתו. אך כשהחוקרים העלימו את האסטרוציטים הסמוכים לגידול באמצעות טיפול מיוחד, התוצאה הייתה דרמטית: בתוך ימים ספורים מתחילת הטיפול, הגידול נעלם, וכל החיות שטופלו נשארו בחיים. גם לאחר שהטיפול הופסק, 80% מהם נותרו בחיים, ולא מתו מהסרטן.
"ראינו שבהיעדר האסטרוציטים הסרטן נעלם ובמרבית המקרים לא חזר. מכך הסקנו שהאסטרוציטים חיוניים לשגשוגו של הגידול הקטלני, וביקשנו להבין כיצד זה קורה: איך ומדוע משתנים האסטרוציטים והופכים מתאים שתומכים בפעילות תקינה של המוח, לתאים שתומכים בגליובלסטומה? אילו פעולות חדשות הם מתחילים לבצע לאחר שהם 'פוגשים' את הגידול הסרטני?", מרחיב ד"ר מאיו.
"מצאנו כי בנוכחות הגידול, האסטרוציטים אכן ממלאים תפקיד עיקרי בגיוס אותם תאים חיסוניים, אך לאחר שהם הגיעו לגידול, האסטרוציטים שהזעיקו אותם גרמו להם 'לעבור צד', ולתמוך בגידול במקום לתקוף אותו"
כדי לבדוק זאת בודדו החוקרים תאי אסטרוציטים ממוחות בריאים ומגידולי מוח, ריצפו את ה-RNA שלהם והשוו ביניהם. ההשוואה העלתה שני שינויים עיקריים שמתחוללים באסטרוציטים לאחר שהם נחשפים לגליובלסטומה. הראשון שבהם קשור לתגובה החיסונית של המוח לגידול.
"ידוע כי עד 40% מהגידול מורכב מתאים של מערכת החיסון, בעיקר מתאים מאקרופג'ים שמגויסים מהדם או מהמוח עצמו. עוד ידוע שאחד מתפקידי האסטרוציטים הוא לשלוח מסרים שמגייסים תאים של מערכת החיסון לאתרים במוח הזקוקים להגנה. אנחנו מצאנו כי בנוכחות הגידול, האסטרוציטים אכן ממלאים תפקיד עיקרי בגיוס אותם תאים חיסוניים, אך לאחר שהתאים החיסוניים הגיעו לגידול, האסטרוציטים שהזעיקו אותם גורמים להם 'לעבור צד', ולתמוך בגידול במקום לתקוף אותו. יותר מכך, גילינו שהאסטרוציטים גורמים לאותם תאי מערכת החיסון לבטא חלבונים מסוימים שמונעים גם מתאים אחרים של מערכת החיסון (לימפוציטים), לתקוף את הגידול, ובכך למעשה הם מגינים עליו ומאפשרים לו להמשיך לגדול", מסביר ד"ר מאיו.
השינוי השני שבאמצעותו תומכים האסטרוציטים בגידול קשור לאספקת אנרגיה, וספציפית לכולסטרול. "גידולי גליובלסטומה זקוקים לכמות גדולה של אנרגיה מכיוון שתאיהם מתחלקים במהירות, אך מחסום הדם-מוח מונע מהם גישה למקורות אנרגיה מהדם. לכן הם שואבים את האנרגיה הדרושה להם מכולסטרול המיוצר במוח עצמו, כלומר 'במפעל' הכולסטרול של האסטרוציטים, שבימים כתיקונם מספק אנרגיה לנוירונים ולשאר תאי המוח", מסביר ד"ר מאיו. "אנחנו מצאנו כי בנוכחות גידול מסוג גליובלסטומה, האסטרוציטים הסמוכים אליו מגבירים את ייצור הכולסטרול, ומספקים אותו לתאי הגידול, וכי תאי הגליובלסטומה תלויים באספקה זו כמקור עיקרי לאנרגיה".
במסגרת המחקר, הנדסו החוקרים את האסטרוציטים הסמוכים לגידול כך שיפסיקו לבטא את החלבון ABCA1, וכתוצאה מכך לא יוכלו עוד לשחרר כולסטרול לגידול. גם כאן התוצאה הייתה דרמטית: כאשר נמנעה מתאי הגליובלסטומה גישה לכולסטרול המיוצר על ידי האסטרוציטים, הגידולים למעשה ׳הורעבו׳ וגוועו תוך ימים ספורים. תוצאות דומות הושגו הן בחיות מודל והן בתאי גידול שהופקו מחולים אנושיים.
"הממצאים האלה מאירים באור חדש את תפקידו של מחסום הדם-מוח בטיפול במחלות מוחיות", אומר ד"ר מאיו. "מחסום זה נועד להגן על המוח בכך שהוא מונע מעבר של חומרים מהדם אל המוח, אך בעת מחלת מוח, הוא מקשה מאוד על מעבר תרופות אל המוח, ולכן נחשב לגורם שמפריע לטיפול. אנחנו מצאנו שבמקרה של גליובלסטומה, מחסום הדם-מוח עשוי דווקא לסייע: הוא מייצר פגיעות מאוד ספציפית של הגידול, שתלוי לחלוטין בכולסטרול המיוצר במוח עצמו, וניתן לתרגם זאת להזדמנות טיפולית ייחודית".
בשלב הבא בחנו החוקרים מאגרי נתונים של מאות חולי גליובלסטומה אנושיים, ומצאו קשר ישיר בין ממצאי המחקר לבין משך הזמן שהחולים שרדו לאחר האבחון (שרידות). החוקרים מסבירים: "עבור כל חולה בחנו את השרידות אל מול רמת הביטוי של גנים הקשורים לשני המסלולים שהשתנו באסטרוציטים בעקבות חשיפה לגליובלסטומה: גיוס תאי מערכת החיסון ואספקת כולסטרול. מצאנו כי חולים שביטאו רמה נמוכה של הגנים הללו חיו זמן רב יותר, ומכך ניתן להסיק כי אותם גנים קשורים לשרידותם של חולי גליובלסטומה".
"בניגוד למודל של בעלי חיים, בבני אדם אין לנו כיום את הכלים לתקוף ישירות את האסטרוציטים. עם זאת, ניתן לפתח תרופות שיתקפו חלבונים המעורבים בתהליכים המזיקים שנגרמים על ידי האסטרוציטים, תהליכים אותם זיהינו במחקר זה", אומר ד"ר מאיו ומסכם "אנחנו מאמינים שהמחקר שלנו מהווה פריצת דרך משמעותית במלחמה נגד גליובלסטומה, ומקווים שממצאיו יהוו בסיס לפיתוח טיפולים לסרטן המוח הקטלני הזה, שעד היום לא נמצא לו כל מענה אפקטיבי, ואף לגידולים נוספים התוקפים את המוח".

ד"ר ליאור מאיו

מחקר
מחקר חדש קובע כי אין עדות מדעית לכך שהקורונה הגיעה מהיונקים המכונפים

זמן קצר לאחר פרוץ מגפת הקורונה החלו להישמע בקרב הציבור, וגם בקרב הקהילה המדעית, האשמות הטוענות כי העטלפים נחשבים כאיום לבריאותנו מעצם היותם 'אוגרי ומפיצי וירוסים', בהם גם נגיף הקורונה. מחקר חדש של אוניברסיטת תל אביב דוחה את הסברות האלו, שאינן מבוססות מדעית ומטעות את הציבור. לדברי החוקרים, במרבית המקרים העטלפים אינם נשאים של וירוסים, ובכל מקרה יש להם מערכת חיסונית יעילה מאוד שמאפשרת להם להתמודד בקלות יחסית עם וירוסים שנחשבים קטלניים עבור יונקים אחרים. יכול מאוד להיות שאפשר ללמוד מהם דבר או שניים על התמודדות עם נגיפים.
המחקר נערך בהובלת ד"ר מאיה ויינברג מהמעבדה של פרופ' יוסי יובל, ראש בית הספר סגול למדעי המוח וחבר סגל בבית הספר לזואולוגיה ובמוזיאון הטבע ע"ש שטיינהרט. לטענת החוקרים, אומנם ישנן עדויות לכך שמקורו של נגיף ה-Covid הקדמוני הפוטנציאלי היה בעטלפים. אבל מנגד, עד היום, שנתיים לאחר שהמגיפה פרצה לראשונה, עדיין איננו יודעים בוודאות מה המקור הישיר של וריאנטCovid-19 . צוות המחקר סקר מחדש עשרות מאמרים ומחקרים מובילים בתחום, ומסקנותיהם התפרסמו בכתב העת היוקרתי ISience.
"העטלפים נתפסים לרוב, בטעות, כמאגרים של מחלות ויראליות, אך ורק בשל היותם חיוביים מבחינה סרולוגית. כלומר, הם בעלי נוגדנים, מה שאומר שהם שרדו את המחלה ופיתחו אליה תגובה חיסונית. אך לאחר מכן גופם התגבר כליל על הווירוס, התנקה ממנו, ולכן הוא כבר לא נשא של אותו וירוס", מסבירה ד"ר ויינברג וממשיכה "יחד עם זאת, במקרים רבים, נגיף שדומה לפתוגן האנושי עלול להימצא בעטלפים, אך הוא אינו פתוגני לבני אדם".
"עלינו ללמוד לעומק את היכולות האימונולוגיות האנטי-ויראליות של העטלפים, כדי לקבל כלים חדשים ויעילים במאבק של האנושות נגד מחלות ויראליות, הזדקנות וסרטן"

ד"ר מאיה ויינברג וידיד
כדי לבחון את המצב הכללי, ביצעו החוקרים מטא-אנליזה של הספרות ובדקו את הממצא עבור יותר מ-100 וירוסים שעבורם עטלפים נחשבו למאגרים פוטנציאליים, בהם נגיף האבולה, ה-SARS וה-COVID. "מצאנו שבחלק ניכר מהמקרים (48%), טענה זו התבססה על שכיחות של נוגדנים או בדיקות PCR, ולא על בידוד הנגיפים הזהים בפועל. יתרה מכך, רבים מהבידודים המדווחים אינם משכנעים: בידוד של וירוס בלבד אינו מספיק כדי לראות בעל חיים כמאגר, שכן נדרשת גם כמות מינימלית של פרטים שבהם מבודד הווירוס על מנת להיחשב חיית מאגר וגם דרך מבוססת להעברה. גם עצם הגילוי של וירוס מסוים בעטלפים אינו מבטיח בהכרח שתתרחש זליגה, ותנאים ביולוגיים, אקולוגיים ואנתרופוגניים רבים נוספים חייבים להתקיים כדי שאירוע כזה יתרחש", מרחיבה ד"ר ויינברג.
לדברי החוקרים, בשנים האחרונות הולכות ומצטברות עדויות לכך שעטלפים יכולים להתמודד עם וירוסים שונים, גם קטלניים, בצורה טובה יותר מאשר בני אדם ומרוב היונקים האחרים. לאחר יותר ממאה שנים של התמקדות בווירוסים שעטלפים נושאים, נראה שמערכת החיסון של העטלפים מאופיינת בתגובה מאופקת בזמן תהליכים דלקתיים.
"לתפיסתנו, העטלפים פיתחו איזון מצוין בין עמידות וסובלנות: תגובת הגנה מוגברת של המארח וסובלנות חיסונית באמצעות מספר מנגנונים שונים. המחקר המקיף שערכנו מעלה ספק גדול באפשר לאפשרות ולפיה מקורה של התפרצות הקורונה הוא בעטלפים. הממצאים מעלים תמונה הפוכה, ולפיה עלינו ללמוד לעומק את היכולות האימונולוגיות האנטי-ויראליות של העטלפים. כך נוכל לקבל כלים חדשים ויעילים במאבק של האנושות נגד מחלות ויראליות, הזדקנות וסרטן", מסכמת ד"ר ויינברג.

מחקר
טכנולוגיה חדשה של חקלאות ימית תסייע לצמצום משבר המזון העולמי: "אצות מועשרות" בעלות ערכים תזונתיים גבוהים במיוחד

חוקרים מאוניברסיטת תל אביב והמכון לחקר ימים ואגמים בחיפה, פיתחו טכנולוגיה חדישה המאפשרת גידול של "אצות מועשרות" באבות המזון, חלבונים, סיבים תזונתיים, ומינרלים לצרכי האדם והחי.
לטענת החוקרים, הטכנולוגיה החדישה הכפילה בצורה משמעותית את קצב הגידול, רמות החלבון, הפחמימות הבריאות, והמינרלים ברקמות האצה - מה שהופך את ה"אצות המעושרות" למזון-על משובח, בעל ערך תזונתי גבוה במיוחד, אשר יוכל לשמש את האדם בעתיד לתעשיות המזון הבריאותי ולאבטחת אפיקי מזון בלתי מוגבלים.
הפיתוח החדש נערך בהובלת הדוקטורנט דורון אשכנזי, בהנחייתם של פרופ' אביגדור אבלסון מהפקולטה למדעי החיים ע"ש ג'ורג' ס. וייז ופרופ' אלוארו ישראל מהמכון לחקר ימים ואגמים (חיא"ל), תל שקמונה, חיפה. המאמר פורסם בכתב העת המדעי Innovative Food Science and Emerging Technologies .
"ניתן להתייחס לאצות הים כ"מזון-על" טבעי, השופע ברכיבים הדרושים לדיאטה של האדם ברמות אשר עולות על מקורות מזון אחרים."

פרופ' אביגדור אבלסון ודורון אשכנזי
"במחקר גודלו מינים מקומיים של אצות: חסנית (Ulva) , אגרית (Gracilaria) ו-היפנאה (Hypnea) בסמיכות למערכות לגידול דגים בתנאי סביבה שונים," מסביר דורון אשכנזי. "התנאים המיוחדים אפשרו שגשוג של האצות, ושיפור נרחב בערכים התזונתיים שלהן עד כדי הפיכתן ל"אצות מועשרות" שהן מזון-על. שימוש באצות כמקור מזון עשיר, אשר עונה על כל צרכיו התזונתיים של האדם, אף מזכיר את המן התנ"כי שממנו ניזונו בני ישראל במדבר. כמו כן, ניתן יהיה להשתמש באצות המעושרות באופן ייעודי לתעשיות בריאות נוספות כגון תוספי תזונה, וכן בענפי הקוסמטיקה והתרופות."
"ניתן להתייחס לאצות הים כ"מזון-על" טבעי, השופע ברכיבים הדרושים לדיאטה של האדם ברמות אשר עולות על מקורות מזון אחרים. באמצעות הגישה הטכנולוגית שפיתחנו, בעל חווה או יזם יוכל לתכנן מראש קו ייצור של אצות ים עשירות בחומרים לפי רצונו, אשר ישמשו כמזון בריא או כתוספי תזונה: דוגמת אצות עם רמת חלבון גבוהה במיוחד, אצות העשירות במינרלים כמו ברזל, יוד, קלציום מגנזיום ואבץ, פיגמנטים ייחודיים, או חומרים אנטי־אוקסידנטים. ניתן יהיה להשתמש באצות המעושרות כדי לסייע לאוכלוסיות הסובלות מתת תזונה וחוסרים תזונתיים, למשל כתוספים לדיאטה צמחונית או טבעונית, וכן לאוכלוסיות מוחלשות ברחבי העולם".

"טכנולוגיות מסוג זה, הן ללא ספק הדוגמה לעתיד טוב יותר לאנושות, עתיד שבו האדם חי באידיליה ובבריאות לצד הסביבה."
כמו כן, בהשוואה לחקלאות יבשתית - החקלאות הימית, ובפרט חקלאות אצות, אינה דורשת קרקעות נרחבות, מים מתוקים או כמויות גדולות של דשנים. היא ידידותית לסביבה ושומרת על הטבע והאיזון האקולוגי בכך שהיא מצמצמת את הסיכונים הסביבתיים. המחקר החדש מייצר למעשה מצב אידיאלי, של חקלאות מקיימת ונקייה. כיום החקלאות הימית המשולבת מתחילה לקבל תמיכה של ממשלות ברחבי העולם בשל יתרונותיה הסביבתיים, בהם: הפחתת עומסי חומרי הזנה בחופים והפחתת הפליטה של גזים וטביעות פחמן. בכך היא תורמת להתמודדות עם משבר האקלים וההתחממות הגלובאלית.
"טכנולוגיות מסוג זה, הן ללא ספק הדוגמה לעתיד טוב יותר לאנושות, עתיד שבו האדם חי באידיליה ובבריאות לצד הסביבה," אומר אשכנזי. "המחקר נערך בשיתוף פעולה של חוקרים מובילים נוספים מרחבי הארץ, בהם גיא פז וד"ר יעל סגל מהמכון לחקר ימים ואגמים לישראל (חיא"ל), חיפה, ד"ר שושנה בן-וליד מומחית לכימיה אורגנית, ד"ר מירב נדב צוברי מהמחלקה לכימיה בפקולטה למדעים מדויקים של אוניברסיטת בר-אילן, וד"ר איתן סלומון מהמרכז הלאומי לחקלאות ימית באילת.


מחקר
חוקרים גילו כי אלמוגים זוהרים גם בעומק כדי לפתות את טרפם

אלמוגים זוהרים מקסימים את חובבי הטבע והמדענים כבר מאות שנים. הם מהווים מקור משיכה לא רק לצוללנים אלא גם לבעלי חיים רבים, לרוב בשוניות הקרובות לחוף. חוקרות וחוקרים ימיים יודעים שיש אלמוגים זוהרים גם בעומק של 45 מטרים, אך תפקידה הביולוגי של התופעה נתון לוויכוח מתמשך. מחקר חדש של אוניברסיטת תל אביב בשיתוף המכון הבין־אוניברסיטאי למדעי הים באילת, הוכיח לראשונה כי התופעה הקסומה בשוניות עמוקות שבה אלמוגים מציגים צבעים זוהרים תחת אור כחול (פלואורסנציה), נועדה לשמש כמנגנון למשיכת טרף. מהמחקר עולה כי בעלי חיים ימיים, אשר נחשבים לטרף של אלמוגים, מזהים את הצבעים הזוהרים ונמשכים לכיוונו.
המחקר נערך בהובלת ד"ר אור בן-צבי ובשיתוף יואב לינדמן וד"ר גל אייל, שלושתם מהמעבדה של פרופ' יוסי לויה בבית הספר לזואולוגיה ומוזיאון הטבע ע"ש שטיינהרדט באוניברסיטת תל אביב. המחקר פורסם בכתב העת Communications Biology.
לדברי החוקרים, במהלך השנים נבדקו מספר השערות, למשל האם התופעה משמשת להגנה מפני קרינה? לייעול הפוטוסינתזה? כפעילות נוגדת חמצון? להגנה מפני אוכלי עשב או למשיכה של אצות סימביוטיות לאלמוג? במחקר העדכני, הוכח כאמור שתפקידו של האור הזוהר הוא לשמש כפיתון עבור הטרף.
במסגרת המחקר, החוקרים ביקשו לבחון את התפקיד המוצע של משיכת טרף. לצורך כך, תחילה הם ביקשו לקבוע האם פלנקטון (יצורים קטנים הנסחפים בים עם הזרמים), נמשכים לפלואורסנציה הן במעבדה והן בים. לאחר מכן החוקרים כימתו במעבדה את יכולות הטריפה של אלמוגים מזופוטיים (אלמוגים שחיים בין אזור שוניות אלמוגים רדודות לבין האזור העמוק והחשוך לחלוטין של האוקיינוס), שמציגים מופעים פלואורסנטיים שונים.
על מנת לבחון את המשיכה הפוטנציאלית של פלנקטון לפלואורסנציה, השתמשו החוקרים בין היתר בסרטן מסוג ארטמיה (Artemia salina), שמשמש בניסויים רבים כמזון לאלמוגים. החוקרים הבחינו כי כאשר ניתנה לסרטן בחירה בין מטרה פלואורסנטית ירוקה או כתומה לעומת מטרת ביקורת שקופה, הסרטן הראה העדפה משמעותית למטרה הפלואורסנטית. המטרה הפלואורסנטית הירוקה משכה יותר מפי שניים סרטנים מן המלכודת השקופה ופי 1.3 יותר מול המטרה הכתומה.
זאת ועוד, כאשר ניתנה לסרטנים בחירה בין שתי מטרות שקופות, התוצאות הראו כי בחירותיו של הסרטן נצפו כמתפלגות באופן אקראי במערך הניסוי. באופן גורף, בכל הניסויים שנערכו במעבדה, הסרטנים הפגינו משיכה מועדפת כלפי אות פלואורסנטי. לעומת הסרטנים, דגים שאינם נחשבים טרף של אלמוגים, לא הציגו את המגמות האלה ודווקא נמנעו ממטרות פלואורסנטיות בכלל וממטרות כתומות בפרט.

"הסרטנים הפגינו משיכה מועדפת כלפי אות פלואורסנטי"
בשלב השני, הניסוי בוצע בבית הגידול הטבעי של האלמוגים בעומק של כ-40 מטרים בעומק הים. גם בניסוי זה המלכודות הפלואורסנטיות (גם הירוקה וגם הכתומה), משכו פי שניים יותר פלנקטון מאשר המלכודת השקופה.
"ערכנו ניסוי בעומק הים על מנת לבחון את המשיכה האפשרית של מאספים מגוונים וטבעיים של פלנקטון לפלואורסנציה, תחת זרמים טבעיים ותנאי האור הקיימים במים העמוקים. מאחר ופלואורסנציה 'מופעלת' בעיקר על ידי אור כחול (האור השולט בעומק הים), בעומקים אלו הפלואורסנציה מודגשת באופן טבעי והנתונים שעלו מהניסוי היו חד משמעיים, בדומה לניסוי המעבדה", מסבירה ד"ר אור בן צבי.
בחלקו האחרון של המחקר נבחנו קצבי הטריפה של אלמוגים מזופוטיים (אלמוגים החיים בעומקים של 30 עד 150 מטרים), שנאספו במפרץ אילת, ונמצא כי אלמוגים שהציגו פלואורסנציה ירוקה נהנו מקצבי טריפה גבוהים בכ-25% לעומת אלמוגים בעלי פלואורסנציה צהובה.
"אלמוגים רבים מציגים תבנית צבע פלואורסצנטית המדגישה את הפה או את קצותיהם של זרועות הציד, עובדה התומכת ברעיון כי פלואורסנציה, בדומה לביו-לומינסנציה (יצירה של אור בתגובה כימית), פועלת כמנגנון משיכה של טרף", מסביר פרופ' לויה וממשיך "המחקר מוכיח כי המראה הזוהר והצבעוני של אלמוגים יכול לפעול כמנגנון פיתוי למשיכת פלנקטון בעל יכולות שחייה אל טורף צמוד קרקע כמו אלמוגים, במיוחד בבתי גידול שבהם האלמוגים דורשים מקורות אנרגיה אחרים בנוסף או כתחליף לפוטוסינתזה (ייצור סוכרים תוך שימוש באנרגיית האור המתבצע על ידי אצה שיתופית החיה בתוך רקמת האלמוג)".
"למרות הפערים בידע הקיים לגבי התפיסה החזותית של אותות אור וצבע על ידי פלנקטון, המחקר הנוכחי מציג עדויות מחקריות התומכות בתפקיד פיתוי טרף של הפלואורסנציה באלמוגים ואנו מניחים שהשערה זו, שאותה אנו מכנים 'השערת מלכודת האור', עשויה לחול גם על אורגניזמים זוהרים אחרים בים ועשויה למלא תפקיד גדול יותר ממה שהוצע בעבר במערכות אקולוגיות ימיות", מסכמת ד"ר בן צבי.

מחקר
חוקרים הצליחו לבודד שלושה גנים שמקנים לחיטה עמידות למחלות

המשבר העולמי באספקת חיטה, שהיא מרכיב המזון הנפוץ בעולם, לא חדש לנו. מאז פרוץ המלחמה בין רוסיה לאוקראינה הוא רק החריף, וכבר שנים שמומחים ומדענים בכל העולם עוסקים במחקר ובפיתוח פתרונות לאבטחת המזון לאוכלוסיית העולם שהולכת וגדלה. הסוד הגדול טמון בפיצוח הגנומי של חיטת הבר הקדומה, שנחשבת לעמידה בפני מחלות ונזקי טמפרטורות, והעברת אותם גנים לחיטה התרבותית המוכרת היום. צוות מחקר בינלאומי בשיתוף חוקרים מאוניברסיטת תל אביב, הצליח לבודד מצמחי בר שלושה גנים אשר עמידים בפני פטריות החילדון. הפטריות גורמות למחלות הקשות ביותר שפוגעות ביבולי החיטה בעולם. בידוד הגנים והעברתם לחיטה התאפשר הודות לסדרת פיתוחים טכנולוגיים, שמקצרים מאד את משך הזמן שדרוש לאיתור ובידוד גנים מצמחי בר והעברתם לצמחי תרבות. לדברי החוקרים, פריצות הדרך הטכנולוגיות יאפשרו בידוד של גנים נוספים למגוון תכונות כגון יבול גבוה ועמידות לפגעי אקלים, וישמשו לפיתוח זני חיטה עתירי יבול ועמידים למחלות, מזיקים ותנאי סביבה.
הצורך לייצר זני חיטה שיכולים לגדול בתנאי סביבה ומזג אוויר קיצוניים ולהתמודד עם מחלות ומזיקים הולך וגדל ככל שמחריף משבר האקלים
שלושת הגנים החדשים בודדו מצמחי בר קרובי משפחה של החיטה, שהם חלק מאוסף הזרעים ששמור בבנק הגנים על שם משפחות ליברמן ואוקינו במכון לחקר הדגניים בפקולטה למדעי החיים ע"ש ג'ורג' ס' וייז. שניים מהגנים מקנים לצמחים חיסון נגד מחלת חילדון הקנה, והם בודדו על ידי צוות מחקר בינלאומי, בהובלה של חוקרים מבריטניה. הגן השלישי בודד על ידי חוקרים מאוניברסיטת תל אביב, והוא מקנה לצמחים עמידות בפני שתי מחלות שונות: חילדון העלה וחילדון הפסים, שתי מחלות שהולכות ומחריפות בגלל עליית הטמפרטורות בעולם. לדברי פרופ' עמיר שרון, ראש המכון לחקר הדגניים, בידוד שלושת הגנים התאפשר הודות לפריצות דרך טכנולוגיות, שינוצלו לבידוד של גנים נוספים למגוון תכונות, כגון יבול גבוה ועמידות לפגעי אקלים, וישמשו לפיתוח זני חיטה עתירי יבול ועמידים למחלות, מזיקים ותנאי סביבה.
צוות חוקרי המכון מסביר כי החיטה מספקת כיום כ-20% מסך כל הקלוריות והחלבון שהאנושות צורכת, ועד 50% במקומות מסוימים בעולם. במהלך התירבות והטיפוח של החיטה, הצטמצם המגוון הגנטי של זני החיטה והם הפכו פגיעים למחלות, למזיקים ולפגעי אקלים. הצורך לייצר זני חיטה שיכולים לגדול בתנאי סביבה ומזג אוויר קיצוניים ולהתמודד עם מחלות ומזיקים הולך וגדל ככל שמחריף משבר האקלים. "כמו שכל אחד מאתנו נושא רק חלק קטן מהגנים של הסבים והסבתות שלו, כך החיטה התרבותית מכילה רק קומץ מסך כל המטען הגנטי של ההורים הקדמונים שלה. מאחר והחיטה נולדה באזור שלנו, צמחי הבר ממשפחת הדגניים שגדלים באזורנו הם ההורים הקדמונים של החיטה התרבותית ומכילים מגוון עשיר של תכונות, שדרושות כדי לטפח זני חיטה משופרים", מסביר פרופ' שרון.
"על ידי השתלת הגנים שבודדנו מצמח הבר בזני חיטה תרבותית, אפשר יהיה להקטין את הנזקים שגורמות המחלות ללא צורך בחומרי הדברה, ובכך לסייע להגדלת היבולים ולשמור על הסביבה"
"לאורך השנים אכן הועברו תכונות מצמחי בר לחיטה, אבל מרבית הפוטנציאל הגנטי עדיין לא נוצל, מאחר ובידוד של גן יחיד יכול היה לקחת למעלה מעשר שנים", אומר פרופ' שרון ומרחיב "לאחרונה היו מספר פריצות דרך, בעיקר התקדמות הטכנולוגיות של ריצוף גנומי ופיתוחים בתחום הביואינפורמטיקה, שבאמצעותם אנחנו יכולים היום לבודד גנים חדשים בתוך פחות משנה. כך, רק בשנה האחרונה בודדו מהחומר שלנו שלושת הגנים שמקנים עמידות נגד מחלות החילדון. על ידי השתלת הגנים שבודדנו מצמח הבר בזני חיטה תרבותית, אפשר יהיה להקטין את הנזקים שגורמות המחלות ללא צורך בחומרי הדברה, ובכך לסייע להגדלת היבולים ולשמור על הסביבה. בנוסף למחלות, אנחנו משתפים פעולה עם חוקרים בארץ ובעולם, שעובדים על בידוד של גנים לתכונות מעניינות נוספות מהחומר שלנו. כך למשל, בשיתוף פעולה עם חוקרים מאוניברסיטת באר שבע בודדו לאחרונה גנים מחיטת בר, שמקנה עמידות לחיטה נגד מזיקים, ואצלנו במכון זיהינו גן חדש מצמחי בני חיטה, שיכול להקנות עמידות ליובש".
פרופ' שרון מוסיף כי במקביל לשיטות לבידוד גנים חדשים, חלה התקדמות גדולה בתחום הביוטכנולוגיה, ובפרט בטכנולוגיות של העברת גנים ועריכה גנומית. טכנולוגיות אלו מאפשרות לשתול גנים חדשים בצמחי תרבות, וכן לשנות את הגנים המקוריים של החיטה כדי להקנות להם תכונות חדשות. במכון הטמיעו את הטכנולוגיות החדשות והיום הם מציעים שירותים של טרנספורמציה ועריכה גנטית של חיטה גם לאוניברסיטאות אחרות ולחברות מסחריות.
בתמיכת המדען הראשי של משרד החקלאות והמרכז הישראלי לעריכה גנומית בחקלאות, הוקם במכון לחקר הדגניים מרכז לטרנספורמציה ועריכה גנומית של חיטה. "זאת אבן דרך משמעותית, כי עד כה לא הייתה אפשרות לבצע טרנספורמציה יעילה של חיטה כאן בישראל. באמצעות הטכנולוגיה הזו אנו יכולים להעביר גנים חדשים, ולהשתמש בשיטות של עריכה גנומית כדי להעניק תכונות חדשות לחיטה. אנחנו מנצלים את המערכות שהקמנו כדי לקדם את המחקרים שנעשים במכון, וגם מסייעים לחברות וחוקרים ממוסדות אחרים בישראל, שזקוקים לטכנולוגיה הזו", אומר פרופ' שרון.
"בבנק הגנים שלנו יש היום למעלה מ 17,000 זרעים של 20 מינים שונים של דגני בר, שנאספו ברחבי ישראל במהלך חמישים השנים האחרונות. הייחודיות של האוסף היא במספר הגדול של מינים שהם קרובי משפחה של החיטה התרבותית, ובכך שחלק גדול של הצמחים נאספו בבתי גידול שכבר לא קיימים עקב הפיתוח העירוני המואץ שעברה ישראל. האוסף הזה הוא למעשה כספת של גנים שדרושים כדי לייצר זני חיטה עתירי יבול ובעלי כושר משופר להתמודדות עם האתגרים של שינויי האקלים. הטכנולוגיות החדשות הן המפתח לכספת: באמצעותן אנחנו יכולים כעת לאתר ושלוף את הגנים הדרושים במהירות ולהעביר אותם לחיטה", מסכם פרופ' שרון.